ВИДЫ И ФАКТОРЫ ИММУНИТЕТА.
ВРОЖДЕННЫЙ И ПРИОБРЕТЕННЫЙ ИММУНИТЕТ
1.1. Формы иммунитета
1.2. Виды иммунитета
1.3. Регуляция иммунного ответа
1.1. ФОРМЫ ИММУНИТЕТА
Специфический иммунный ответ развивается в организме параллельно с развитием инфекции или после вакцинации и приводит к формированию ряда специфических эффекторных механизмов противоинфекционной защиты:
- Гуморальный иммунный ответ (В–лимфоцит);
- Клеточный иммунный ответ (Т–лимфоцит);
- Иммунологическая память (Т– и В–лимфоциты);
- Иммунологическая толерантность.
К этим механизмам относятся эффекторные молекулы (антитела) и эффекторные клетки (Т–лимфоциты и макрофаги) иммунной системы.
Гуморальные иммунные реакции
В гуморальных иммунных реакциях участвуют три клеточных типа: макрофаги (Аг–представляющие клетки), Т–хелперы и В–лимфоциты.
Аг–представляющие клетки фагоцитируют микроорганизм и перерабатывают его, расщепляя на фрагменты (процессинг Аг). Фрагменты Аг выставляются на поверхности Аг–представляющей клетки вместе с молекулой МНС. Комплекс «Аг–молекула МНС класса II» предъявляется Т–хелперу. Распознавание комплекса Т–хелпером стимулирует секрецию ИЛ–1 макрофагами.
Т–хелпер под действием ИЛ–1 синтезирует ИЛ–2 и рецепторы к ИЛ–2; последний стимулирует пролиферацию Т–хелперов, а также ЦТЛ. Таким образом, после взаимодействия с Аг–представляющей клеткой Т–хелпер приобретает способность отвечать на действие ИЛ–2 бурным размножением. Биологический смысл этого явления состоит в накоплении Т–хелперов, обеспечивающих образование в лимфоидных органах необходимого пула плазматических клеток, вырабатывающих АТ к данному Аг.
В–лимфоцит. Активация В–лимфоцита предполагает прямое взаимодействие Аг с молекулой Ig на поверхности В–клетки. В этом случае сам В–лимфоцит перерабатывает Аг и представляет его фрагмент в связи с молекулой МНС II на своей поверхности. Этот комплекс распознает Т–хелпер, отобранный при помощи того же Аг. Узнавание рецептором Т–хелпера комплекса Аг–молекула МНС класса II на поверхности В–лимфоцита приводит к секреции Т–хелпером ИЛ–2, ИЛ–4, ИЛ–5, ИЛ–6, под действием которых В–клетка размножается, образуя клон плазматических клеток (плазмоцитов). Плазмоциты синтезируют антитела. Часть зрелых В–лимфоцитов после антигензависимой дифференцировки циркулируют в организме в виде клеток памяти.
Антитела, специфически взаимодействуя с антигенными детерминантами (эпитопами) на поверхности микроорганизмов, образуют с ними иммунные комплексы, что ведет к активации мембраноатакующего комплекса системы комплемента и лизису микробных клеток. Кроме того, иммунные комплексы, включающие микроорганизмы и специфические антитела, быстрее и легче захватываются фагоцитирующими клетками организма при участии Fc–рецепторов. При этом ускоряется и облегчается внутриклеточная гибель и переваривание. Защитная роль антител в антитоксическом иммунитете определяется также их способностью нейтрализовать токсины. Секреторные иммуноглобулины класса А обеспечивают местный специфический иммунитет слизистых оболочек, препятствуя прикреплению и проникновению патогенных микроорганизмов.
Вместе с тем гуморальная защита малоэффективна против внутриклеточно паразитирующих бактерий, риккетсий, хламидий, микоплазм, грибов, простейших и вирусов. Против этих возбудителей более эффективны клеточные механизмы специфического иммунитета, к которым относится иммунное воспаление – реакция гиперчувствительности замедленного типа (ГЗТ) и цитотоксическая активность Т–киллеров, NК–клеток, макрофагов.

Рис. 1. Гуморальный иммунный ответ.
В результате кооперации макрофагов, Т–хелперов и В–лимфоцитов и дальнейшей дифференцировки
В–лимфоцитов в плазматические клетки, последние продуцируют антитела, которые нейтрализуют антиген.
Клеточные иммунные реакции
В очаге иммунного воспаления Т–эффекторы ГЗТ, активированные при контакте с микробными антигенами, продуцируют лимфокины, индуцирующие микробоцидные механизмы фагоцитов. В результате усиливается внутриклеточная гибель захваченных фагоцитами возбудителей.
Гибель клеток–»мишеней» вместе с паразитирующими в них возбудителями может наступить вследствие их распознавания Т–киллерами, специфически сенсибилизированных против микробных антигенов.
Другой механизм гибели зараженных клеток носит название антителозависимой цитотоксичности (АЗЦТ). Он заключается в распознавании микробных антигенов на мембране зараженной клетки–»мишени» антителами, адсорбированными на Fc–рецепторах NK–клеток или макрофагов. При этом цитотоксичность является результатом действия лизосомных ферментов и других продуктов секреции данных клеток.
В целом клеточные механизмы обеспечивают защиту организма против факультативно и облигатно внутриклеточных паразитов, что позволяет оценивать напряженность специфического иммунитета по результатам кожно–аллергической реакции. Этим же объясняется и тот факт, что наиболее эффективными для специфической профилактики таких инфекций являются вакцины из живых ослабленных микроорганизмов, активирующие клеточные механизмы иммунитета.
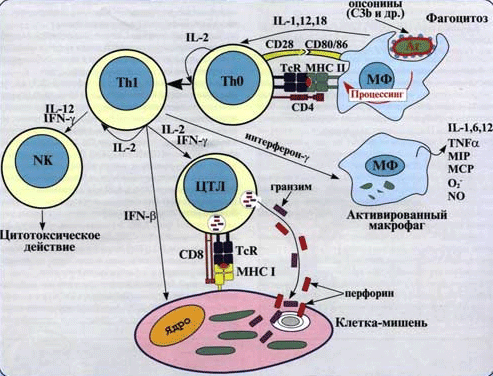
Рис. 2. Клеточный иммунный ответ опосредован активированными
Т–хелперами макрофагами и другими фагоцитирующими клетками, а также цитотоксическими Т–лимфацитами.
Иммунологическая память
Иммунологическая память – способность организма отвечать на повторное введение антигена иммунной реакцией, характеризующейся большей силой и более быстрым развитием.
Клетки иммунологической памяти – долгоживущие Т– и В–лимфоциты, сохраняющие многие годы способность реагировать на повторное введение антигена, так как вырабатываются рецепторы к этому антигену. Иммунологическая память проявляется как ускоренный специфический ответ на повторное введение антигена.
Иммунологическая память к антигенным компонентам окружающей среды лежит в основе аллергических заболеваний, а к резус–антигену (возникает при резус–несовместимости беременности) – в основе гемолитической болезни новорожденных. Феномен иммунологической памяти используется в практике вакцинации людей.
Иммунологическая толерантность
Иммунологическая толерантность – явление, противоположное иммунному ответу и иммунологической памяти, проявляющееся в том, что на введение антигена вместо выработки иммунитета в организме развивается ареактивность, инертность, отсутствие ответа на антиген.
Иммунный ответ против собственных тканей организма в нормальных условиях не развивается, т.е. иммунная система толерантна к подавляющему большинству Аг тканей организма (аутоантигены). Искусственная толерантность к чужеродным Аг может быть вызвана иммунизацией по определенной схеме (например, толерантность «низкой дозы» – дробное введение Аг в возрастающих количествах или толерантность «высокой дозы» – однократное введение Аг в высокой дозе).
1.2. ВИДЫ ИММУНИТЕТА
Многообразие систем защиты организма позволяют человеку оставаться невосприимчивым к действию инфекционных агентов.
Видовой иммунитет (врожденный) – генетически закрепленная невосприимчивость присущая каждому виду. Например, человек никогда не заболевает чумой крупного рогатого скота. Крысы резистентны к дифтерийному токсину.
Приобретенный иммунитет формируется в течение жизни индивидуума и не передается по наследству; может быть естественным и искусственным, активным и пассивным.
Естественно приобретенный иммунитет (активный) развивается после перенесенного инфекционного заболевания, протекавшего в клинически выраженной форме, либо после скрытых контактов с микробными Аг (так называемая бытовая иммунизация). В зависимости от свойств возбудителя и состояния иммунной системы организма невосприимчивость может быть пожизненной (например, после кори), длительной (после брюшного тифа) или сравнительно кратковременной (после гриппа).
Инфекционный (нестерильный) иммунитет – особая форма приобретенной невосприимчивости; не является следствием перенесенной инфекции, обусловлен наличием инфекционного агента в организме. Невосприимчивость исчезает сразу после элиминации возбудителя из организма (например, туберкулез; вероятно, малярия).
Естественный пассивный иммунитет связан с переносом IgG от матери к плоду через плаценту (передача по вертикали) или с грудным молоком (SIgA) новорожденному. Это обеспечивает устойчивость новорожденного ко многим возбудителям в течение некоторого, обычно индивидуально варьирующего срока.
Искусственно приобретенный иммунитет. Состояние невосприимчивости развивается в результате вакцинации, серопрофилактики (введение сыворотки) и других манипуляций.
Активно приобретенный иммунитет развивается после иммунизации ослабленными или убитыми микроорганизмами либо их антигенами. В обоих случаях организм активно участвует в создании невосприимчивости, отвечая развитием иммунного ответа и формированием пула клеток памяти.
Пассивно приобретенный иммунитет достигается введением готовых АТ или, реже, сенсибилизированных лимфоцитов. В таких ситуациях иммунная система реагирует пассивно, не участвуя в своевременном развитии соответствующих иммунных реакций.
Иммунитет может формироваться против микроорганизмов, их токсинов, вирусов, антигенов опухолей. В этих случаях иммунитет называют антимикробным, антитоксическим, антивирусным, противоопухолевым соответственно. При трансплантации несовместимых тканей возникает трансплантационный иммунитет (реакция отторжения трансплантата).
Поступление в организм антигена через дыхательные пути, пищеварительный тракт и другие участки слизистых поверхностей и кожи нередко обуславливает развитие выраженной локальной иммунной реакции. В таких случаях речь идет о местном иммунитете.
1.3. РЕГУЛЯЦИЯ ИММУННОГО ОТВЕТА
Интенсивность и продолжительность иммунного ответа контролируется и регулируется при участии ряда механизмов обратной связи на генетическом, клеточном и организменном уровнях.
Генетический контроль иммунного ответа связан с наличием конкретных генов, контролирующих синтез и выход специфических рецепторов на поверхность иммунокомпетентных клеток, что непосредственно влияет на уровень представления и распознавания антигена.
Иммунная система представляет собой комплекс взаимодействующих клеток, связанных между собой внутренними регуляторными связями посредством цитокинов.
На уровне организма осуществляется взаимодействие нервной, эндокринной и иммунной систем, иммунный ответ контролируется и регулируется нейрогуморальными механизмами, среди которых ведущую роль играют кортикостероидные гормоны, подавляющие процессы пролиферации, дифференцировки и миграции лимфоидных клеток и ингибирующие биосинтез интерлейкинов.
Воспаление – сумма защитно–адаптивных реакций, развивающихся в тканях при их повреждении; впоследствии они могут полностью восстанавливать свою структуру и функции либо в них формируются стойкие дефекты. Хорошо известны классические признаки, характеризующие острое воспаление: покраснение, отек, боль, локальное повышение температуры и нарушение функций органа или ткани. Если интенсивность острой реакции оказывается недостаточной для элиминации возбудителя, то она меняет свои характеристики и принимает хроническое течение.
С позиции защиты от патогенов большинство системных реакций острого воспаления резко изменяет лимфо– и кровообращение в очаге. Вазодилатация и повышение проницаемости капилляров облегчает выход из просвета капилляров больших молекул (например, компонентов комплемента) и полиморфонуклеаров. Весьма важным фактором является снижение рН в воспаленных тканях, обусловленное преимущественно секрецией молочной кислоты фагоцитами. Снижение рН оказывает губительное действие на бактерии, повышает микробицидную активность низкомолекулярных органических кислот и снижает резистентность к действию антимикробных химиопрепаратов.
Любое инфекционное воспаление начинается с запуска комплементарного каскада и активации свертывающей системы, многие компоненты которых известны как медиаторы воспалительных реакций.
|