Практическое занятие по теме:
РЕАКЦИИ ИММУНИТЕТА И ИХ ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ
1.1. Механизмы взаимодействия антигена с антителом
1.2. Реакция преципитации (РП). Постановка, учет результатов
1.3. Иммуномикробиологические исследования
1.1. МЕХАНИЗМЫ ВЗАИМОДЕЙСТВИЯ АНТИГЕНА С АНТИТЕЛОМ
Взаимодействие антигена со специфическим антителом проявляется в организме образованием иммунных комплексов. Прочному взаимодействию АГ с АТ способствуют: количество детерминант в АГ, количественное соотношение, последовательность расположения концевых групп аминокислот в детерминанте, наличие в детерминанте ароматических аминокислот, аффинность и авидность. Аффинитет – это связь одного активного центра (Fab 1или Fab 2) и детерминанты.
Авидность – это cвязь всех активных цетров с детерминантами.
Свойства комплекса АГ – АТ. Аффинитетом и авидностью измеряется прочная взаимосвязь с поверхностными структурами АГ и АТ.
Реакции АТ с АГ протекают также в системе «in vitro»то есть «в пробирке» и имеют ряд типичных характеристик: потребность в электролитах, обратимость, двухфазность (фаза взаимодействия активного центра АТ и детерминант АГ –несколько секунд или минут; фаза проявления – визуально наблюдаемый эффект несколько минут или часов). При соприкосновении гидрофобных групп белков в воде наступает их взаимное притяжение.
Часто такие реакции называют серологическими (от латинского «serum» – сыворотка), так как источником АТ служит сыворотка крови.
В связи с высокой чувствительностью и специфичностью серологические реакции нашли широкое диагностическое применение.
Серологические реакции применяют для двух целей:
- По известному АГ определяют в исследуемой сыворотке титр специфических к данному АГ антител. Титром сыворотки называют то ее максимальное разведение, которое еще дает положительную реакцию с соответствующим АГ.
- С помощью известного АТ, т.е. диагностической иммунной сыворотки, определяют наличие в исследуемом материале специфического антигена или осуществляют серологическую идентификацию выделенной чистой культуры возбудителя.
Все серологические реакции можно разделить на несколько групп:
- Реакции, протекающие с укрупнением частиц АГ в растворе электролита: реакция агглютинации в ее различных вариантах, реакция преципитации и ее различные модификации.
- Реакции, протекающие с участием комплемента: реакция связывания комплемента, иммунного гемолиза и их модификации.
- Реакции, протекающие с нейтрализацией антигена: реакции нейтрализации токсинов, вирусов, реакции торможения гемагглютинации.
- Реакции, протекающие с участием фагоцитоза: опсонофагоцитарная реакция и другие.
- Реакции иммунофлюоресценции в различных вариантах.
- Реакции иммуносорбентного анализа твердой фазы: ИФА, РИА.
Для серологических реакций могут быть использованы целые клетки (корпускулярные антигены), например, лимфоциты, плазмоциты, клетки, пораженные вирусами, и т.д. (РИФ, РИА, ИФА); бактериальные клетки (РА, РИФ, РИА, ИФА); а также растворимые компоненты (растворимые, молекулярные АГ) для реакции преципитации, нейтрализации, ИФА и других.
Корпускулярный АГ – это живые или убитые (инактивированные) клетки в изотонических или буферных растворах. При инактивации клеток пользуются методами, не вызывающими изменения специфичности и снижения иммуногенных свойств. Стандартные антигены из инактивированных патогенных микроорганизмов широко применяются в серологическом анализе при обнаружении антител в сыворотках людей и животных.
С помощью серологических реакций выявляют у исследуемых бактериальных клеток антигенный состав. Взвеси эритроцитов, лимфоцитов, опухолевых клеток в серологических реакциях используют для определения локализованных на их поверхностных мембранах АГ групп крови, СД–маркеров, трансплантационных, опухолеспецифических и других АГ, а также для обнаружения в сыворотках АТ к этим антигенам.v
Антигены выделяют и очищают фракционированием различными методами с использованием моноклональных антител.
Иммунная сыворотка (антисыворотка) представляет собой сыворотку крови, содержащую антитела к данному антигену. В большинстве случаев иммунные (диагностические) сыворотки к микробным, тканевым и другим антигенам получаютэкспериментальным путем, иммунизируя животных соответствующими антигенами. По специфичности различают поливалентные (полиспецифические) и моновалентные (моноспецифические) антисыворотки. Поливалентные сыворотки содержат антитела ко многим антигенам, моноспецифические – к одному конкретному антигену.
1.2. РЕАКЦИЯ ПРЕЦИПИТАЦИИ (РП). ПОСТАНОВКА, УЧЕТ РЕЗУЛЬТАТОВ
РЕАКЦИЯ ПРЕЦИПИТАЦИИ – это агрегация антителами (преципитинами) растворимых (молекул) АГ (преципитиногенов), проявляющаяся в помутнении прозрачной жидкости, в появлении преципитата в виде осадка, кольца и т.д.
Антиген для реакции преципитации обязательно должен быть в молекулярном виде. Механизм реакции преципитации аналогичен реакции агглютинации, т.е. по «теории решетки».
Осаждение из раствора комплексов АГ – АТ происходит в диапазоне эквивалентных соотношений концентраций взаимодействующих молекул. В случае большого избытка одного из реагентов образуется растворимый комплекс АГ–АТ и феномен реакции не проявляется. Поскольку преципитиноген имеет ультрамикроскопическое строение и его концентрация в единице объема выше, чем АТ в таком же объеме сыворотки, то для осаждения более легких частичек АГ с образованием видимого преципитата необходимо значительно большее количество АТ. Поэтому диагностические преципитирующие сыворотки выпускают с высоким титром АТ.
Реакцию преципитации можно проводить в жидкой и твердой среде.
Классическая реакция преципитации в жидкой среде по Асколи
Обязательным условием постановки реакции преципитации (РП) в жидкой среде является максимальная прозрачность иммунореагентов. Реакция происходит при смешивании растворов АГ и АТ(метод подслаивания) или наслоения одного иммунореагента на другой. В этом случае по характеру образовавшего преципитата (в виде кольца) реакция получила название кольцепреципитации.
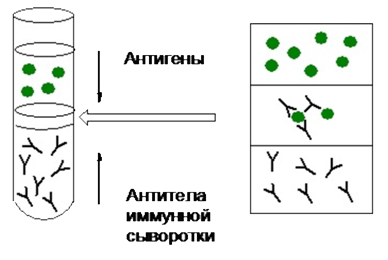
Положительной считается реакция когда в зоне взаимодействия жидкостей, содержащих Аг и Ат образуется дымчатое кольцо. Данная реакция в ветеринарной практике используется для обнаружения возбуделя сибирской язвы в кожевенном и прочем сырье, а также для изучения АГ структуры бактерий, сложных белков, жидкостей человека и животных; для изучения токсигенности бактерий; при диагностике ряда инфекционных заболеваний бактериальной, вирусной, грибковой природы (сибирской язвы, чумы, туляремии и т.д.); В качестве АГ используют раневые экссудаты, фильтраты экстрактов пораженных органов, спинно–мозговую жидкость и т.д. Для установления степени родства видов микроорганизмов, определяют общий АГ; в судебно–медицинской практике – для определения видовой принадлежности белков (крови, слюны, спермы и т.д.);идля выявления примесей в мясных, рыбных, мучных изделиях.
Реакция преципитации в агаре ( геле )реакция Оухтерлони.
Для реакции используют гель, приготовленный из агара Дифко или же специально приготовленный предельно осветленный гель из агар–агара.
Сущность реакции заключается в том, что специфические Ат и АГ диффундируют в гель, взаимодействуя между собой, и образуют комплекс, который осаждается в виде линии преципитата. Радиальная иммунодиффузия в геле может быть простой и двойной.
Иммунодиффузия по Оухтерлони
В агаре, разлитом тонким слоем в чашки или же на предметное стекло, вырезают лунки на равном расстоянии друг от друга ( 4 – 10 мм ) при помощи специальных штампов или стеклянных трубок с ровными краями. В лунки вносят раствор сыворотки или раствор антигена в различных разведениях. Из лунок АГ и АТ диффундируют навстречу друг другу и образуют преципитат в виде тонких белесоватых линий.
Поскольку диффузия реагентов из лунок в гель происходит радиально, это позволяет анализировать сразу несколько образцов иммунореагентов, разместив вокруг лунки с антисывороткой несколько лунок с растворами разных антигенов; или наоборот, заполняя периферические лунки антисывороткой, а центральную искомым антигеном; или в центральную лунку внести известный АГ, а в периферические – исследуемую сыворотку в разных разведениях.
Метод двойной иммунодиффузии применяют преимущественно для качественного анализа, для определения природы АГ и АТ, но можно использовать и для полуколичественного определения АГ и АТ путем их титрования.
Для количественного определения антигена часто используют простую радиальную иммунодиффузию по Манчини, которая основана на измерении диаметра кольца преципитации, образующегося при внесении раствора исследуемого АГ в лунки, вырезанные в слое геля, в котором предварительно диспергирована моноспецифическая антисыворотка.
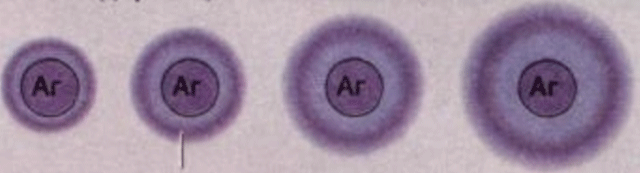
В стандартных условиях опыта диаметр кольца преципитации прямо пропорционален концентрации исследуемого АГ. Содержание АГ определяют относительно стандартного раствора АГ с известной его концентрацией. Чаще всего при помощи этого метода определяют белковые АГ: количество Yg разных классов в сыворотке крови и других жидкостях, секретов желез, белков крови, спинномозговой жидкости и т.д.
Реакцию иммунодиффузии обычно поводят при комнатной температуре, во влажных камерах. Продолжительность иммунодиффузии зависит от природы АГ.
Методы иммунодиффузии обладают высокой специфичностью и чувствительностью.
Реакция флокуляции – вид иммунопреципитации, при котором преципитат представляет собой хлопьевидную массу. Реакцию проводят смешиванием разных разведений сыворотки со стандартным количеством раствора АГ в объеме 2 мл.
Первая пробирка, где появились хлопья ( инициальная флоккуляция ) указывает на эквивалентное соотношение АГи АТ. По инициальной флоккуляции рассчитывают количество сыворотки или АГ, исходя из активности взятых в опыт стандартных препаратов. Применяется для определения токсинов микроорганизмов в исследуемом материале.
1.3. ИММУНОМИКРОБИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
Иммунологические методы применяют для решения многих задач:
- Оценка состояния иммунной системы человека (иммунного статуса) по определению количественных и функциональных характеристик клеток иммунной системы и их продуктов.
- Определение состава и характеристик тканей человека: групп крови, резус фактора, трансплантационных антигенов.
- Диагностика инфекционных болезней и резистентности к ним по обнаружению и установлению титров антител (серодиагностика), выявлению антигенов возбудителей в организме, определению клеточных реакций на эти антигены.
- Сероидентификация культур бактерий и вирусов, выделенных из организма человека и животных.
- Выявление в организме человека и во внешней среде любых веществ, обладающих антигенными или гаптенными свойствами (гормоны, ферменты, яды, лекарства, наркотики и т.п.).
- Выявление иммунопатологических состояний, аллергий, трансплантационных и противоопухолевых реакций.
В основе иммунологических методов лежат серологические реакции, для постановки которых используют сыворотку (serum), содержащую антитела (основаны на взаимодействии антигенов и антител) и клеточные реакции, базирующиеся на взаимодействии антигенов (аллергенов) с Т–клетками.
Иммуномикробиологические исследования – вид микробиологического экспресс–анализа по выявлению специфических антител и антигенов.
Процесс взаимодействия антигена и антитела в серологических реакциях протекает в две фазы:
- специфическая – фаза взаимодействия, в которой происходит комплементарное соединение активных центров антител (паратопов) и эпитопов антигена. Обычно эта фаза длится несколько секунд или минут;
- неспецифическая – фаза проявления, характеризуется внешними признаками образования иммунных комплексов. Эта фаза может развиваться от нескольких минут до нескольких часов.
Оптимальное специфическое взаимодействие антител с антигеном происходит в изотоническом растворе с рН, близким к нейтральному. Реакция антиген–антитело в системе in vitro может сопровождаться возникновением нескольких феноменов – агглютинации, преципитации, лизиса. Внешние проявления реакции зависят от физико–химических свойств антигена (размер частиц, физическое состояние), класса и вида антител (полные и неполные), а также условий опыта (консистенция среды, концентрация солей, рН, температура).
Поливалентность антигенов и антител обеспечивает возникновение видимых невооруженным глазом агрегатов. Это происходит в соответствии с теорией образования сетей, согласно которой к образовавшемуся комплексу антиген–антитело последовательно присоединяются другие молекулы антител и антигена. В результате формируются сетевые структуры, которые превращаются в агрегаты, выпадающие в осадок. Характер и выраженность реакции зависят от количественного соотношения антигенов и антител. Наиболее интенсивно реакции проявляются в том случае, если реагенты находятся в эквивалентном соотношении.
Необходимое условие образование решетки (сетей) – наличие более трех антигенных детерминант на каждую молекулу антигена и по два активных центра на каждую молекулу антитела. Молекулы антигена являются узлами решетки, а молекулы антител – связующими звеньями. Область оптимальных соотношений (зона эквивалентности) концентраций антигена и антител, когда в надосадочной жидкости после образования осадка не обнаруживаются ни свободные антигены, ни свободные антитела.
Агрегаты, способные выпадать в осадок, образуются при соединении антигенов с полными антителами. Неполные антитела (моновалентные) не вызывают образования сетевых структур и крупных агрегатов. Для выявления таких антител используют специальные методы, основанные на использовании антиглобулинов (реакция Кумбса).
Серологические реакции, благодаря высокой специфичности и чувствительности, применяют для выявления и количественного определения антигенов и антител. Количество иммунореагентов в реакциях выражают титром – максимальным разведением сыворотки или антигена, при котором еще наблюдается реакция.
Серологические реакции в микробиологических и иммунологических лабораториях используют в двух целях:
- для сероидентификации микроорганизмов, токсинов, антигена вообще с помощью известного антитела (иммунной диагностической сыворотки),
- для серодиагностики – определения природы антитела в сыворотке крови больного при бактериальных, вирусных, реже других инфекционных заболеваниях с помощью известного антигена (диагностикума).
Для определения родовой, видовой и типовой принадлежности антигена необходимы заведомо известные иммунные диагностические сыворотки. Их получают путем многократного введения животным (чаще кроликам) в нарастающих дозах убитых или живых микроорганизмов, продуктов их распада, обезвреженных или нативных токсинов. После определенного цикла иммунизации животных делают массивное кровопускание или тотальное обескровливание животного. Кровь, собранную в стерильную посуду, сначала помещают в термостат при температуре 37°С на 4 – 6 ч для ускорения свертывания, затем – в ледник на сутки. Полученную прозрачную сыворотку отсасывают в стерильную посуду, добавляют консерванты, определяют титр антител, проверяют на стерильность и разливают в ампулы.
Используются неадсорбированные и адсорбированные диагностические сыворотки. Неадсорбированные сыворотки обладают высокими титрами антител, но способны давать групповые (перекрестные) реакции. Адсорбированные сыворотки отличаются строгой специфичностью действия (реагируют только с гомологичным антигеном). Сыворотки, содержащие антитела только к одному определенному антигену называются монорецепторными.
Выпускают также сыворотки, меченные флюорохромами, ферментами, радиоизотопами, которые позволяют с высокой степенью точности обнаружить даже следы антигена.
В качестве антигенов (диагностикумы) в серологических реакциях применяют взвеси живых или убитых бактерий, продуктов их расщепления, токсины, вирусы. В ряде случаев используют экстракты или выделенные химическим путем антигены из микроорганизмов и тканей животных.
Все иммуномикробиологические методы можно разделить на 3 группы:
- основанные на прямом взаимодействии антигена с антителом (феномены агглютинации, преципитации, гемагглютинации, иммобилизации и др.);
- основанные на опосредованном взаимодействии антигена с антителом (реакции непрямой гемагглютинации, коагглютинации, латекс–агглютинации, угольной аггломерации, бентонит–агглютинации, связывания комплемента и др.);
- с использованием меченых антител или антигенов (метод флюоресцирующих антител, иммуноферментный и радиоиммунный анализы и другие методы).
К числу современных сложных методов иммунологической диагностики относят: иммуноферментный анализ, имммуносенсоры, методы генного зондирования, иммуноэлектрофорез и иммуноблоттинг.
Иммуноблотинг – один из современных высокоточных вариантов электрофореза с анализом разделенных белков иммунологическим методом. Тест осуществляется в три этапа: сначала проводится–электрофорез в полиакриламидном геле в присутствии ионного детергента додецилсульфата натрия. Разделенные антигены переносятся за счет капиллярных сил или дополнительного электрофореза на иммобилизующую нитроцеллюлозную мембрану. Находящиеся на мембране антигены анализируются с помощью меченых ферментной или радиоактивной меткой антител (иммуноферментным или радиоиммунным методом).
Впервые принцип иммуносенсоров был использован М. Аizawа и соавт. (1977), когда они сконструировали мембрану, способную на иммунологический ответ. В настоящее время опубликовано несколько сообщений об использовании аналогичного подхода для определения различных микробных антигенов или антител к ним [Horbach Е. еt аl, 1989, Parry R. еt аl., 1990].
Принцип методов, основанных на иммуносенсорной технологии, заключается в изменении физико–химических свойств мембраны или другого носителя, связанного с антителами или антигенами. Уменьшение мембранного потенциала, изменение оптических или химических свойств среды, прилегающей к носителю, выявляются с помощью специального электрода или оптического устройства и выражаются в виде электрического сигнала.v
Существует два основных типа иммуносенсоров, различающихся по особенностям определения реакции антиген – антитело. 1 тип – так называемый немеченый иммуносенсор. Такое устройство состоит из металлического электрода для потенциометрии, покрытого полупроницаемой полимерной мембраной с иммобилизованными на ней молекулами антител (или антигена). В результате реакции с искомым комплементарным веществом образуются иммунные комплексы на поверхности мембраны.
Это приводит к изменению заряда мембраны и ее поверхностного потенциала. Изменение разности потенциалов и определяется электродом. 2 тип – меченый иммуносенсор. В этом случае на мембране также иммобилизуются антитела или антиген, но реакция определяется по изменению проводимости (амперметрия). Для этого используют кислородный электрод, реагирующий на изменение концентрации О2 после реакции антител с антигеном, меченым ферментом (например, каталазой). Конкуренция искомого антигена с известным количеством меченого конъюгата дает изменение проводимости раствора в области мембраны, что реализуется в виде электрического сигнала на выходе электрода.
В другой модификации результат цветной ферментативной реакции может быть определен и с помощью оптического устройства.
Для оценки результатов реакции в двух описанных типах иммуносенсоров значительно реже используют пьезоэлектрический эффект, измерение температурных колебаний и некоторые другие способы, менее разработанные в равнении с электрохимическими и оптическими.
Особенностью иммуносенсоров, отличающей их от других систем иммунохимической диагностики, является то, что информация о возникновении иммунного комплекса непосредственно реализуется в виде физического сигнала – изменения разницы потенциалов, оптической плотности, силы тока и т. п.
Одним из первых применений иммуносенсоров было измерение количества антител при сифилисе. Для этого на полупроницаемой мембране электрода связывали антигены трепонемы и инкубировали его в растворе сыворотки крови. Изменения разницы потенциалов наблюдали вплоть до разведения положительной контрольной сыворотки 1:800, причем, увеличение сигнала соответствовало повышению концентрации антител. Важно то, что после отмывания иммуносенсор можно использовать вновь. Аналогичный подход был применен для определения антител другой специфичности (к групповым антигенам крови) и альбумина.
Более сложное строение иммуносенсора увеличивает чувствительность анализа. Так при использовании меченого иммуносенсора достигается чувствительность до 0,1 нг белка/мл. Имеются данные об определении таким методом HBs– антигена с помощью I–электрода и антител к HBs–антигену, меченых пероксидазой. Устройство, включающее стеклянную матрицу, активированную различными вирусными антигенами (биочип) было использовано для серологической диагностики вирусных заболеваний. Предприняты попытки определять с помощью иммуносенсоров продукты синтеза некоторых грибов (охратоксин А), клетки С. Albicans. в настоящее время отсутствуют коммерческие образцы иммуносенсоров для диагностики инфекционных заболеваний, следует обратить внимание на основные этапы использования подобных устройств.
Опыт использования аналогичных систем для определения глюкозы в крови, гормонов, низкомолекулярных веществ позволяет разделить процесс анализа на три этапа:
- подготовка образца для анализа. Некоторые типы иммуносенсоров способны взаимодействовать непосредственно с биологическим материалом. Однако чаще всего используется предварительно отделенная центрифугированием плазма или сыворотка крови, разведенная специальным раствором.
- проведение аналитической процедуры. Помещая каплю раствора на микроэлектрод, или опуская электрод в исследуемый образец, создается контакт реагентов. Время достижения равновесия от нескольких секунд (для низкомолекулярных веществ) до нескольких минут (для высокомолекулярных агентов, антигенов, клеток). Результат определяется по разнице в показаниях с референс–электродом или по изменению сигнала после реакции. Результат может быть выражен в систематических единицах (милливольт, миллиампер), либо с помощью микропроцессора трансформирован в единицы концентрации искомого агента, в соответствии с предварительным калиброванием.
- регенерация иммуносенсора. Для повторного или многократного использования иммуносенсора необходимо освободить его рабочую поверхность от веществ, активно или пассивно сорбированных в ходе анализа. Наиболее простой способ регенерации состоит в интенсивном последовательном промывании иммуносенсора раствором с кислым значением рН и буферным раствором с высокой ионной силой. Для некоторых типов иммуносенсоров до сих пор не найдено оптимальных условий регенерации, не снижающих их чувствительность. В этих случаях используют сменные одноразовые мембранные элементы. В ближайшее время будут созданы надежные портативные иммуносенсоры для диагностики наиболее распространенных инфекционных заболеваний, как это сделано уже для анализаторов глюкозы.
|