|
4.4.1. Гипотеза де Бройля
4.4.2. Волновая функция и ее физический смысл
4.4.3. Соотношение неопределенностей
4.4.4.Уравнение Шредингера
4.4.5. Применение уравнения Шредингера к атому водорода. Квантовые числа
ТЕМА 4.4 ВОЛНОВЫЕ СВОЙСТВА ЧАСТИЦ
4.4.1. Гипотеза де Бройля
Важным этапом в создании квантовой механики явилось обнаружение волновых свойств микрочастиц. Идея о волновых свойствах была первоначально высказана как гипотеза французским физиком Луи де Бройлем.
В физике в течение многих лет господствовала теория, согласно которой свет есть электромагнитная волна. Однако после работ Планка (тепловое излучение), Эйнштейна (фотоэффект) и других стало очевидным, что свет обладает корпускулярными свойствами.
Чтобы объяснить некоторые физические явления, необходимо рассматривать свет как поток частиц-фотонов. Корпускулярные свойства света не отвергают, а дополняют его волновые свойства.
Итак, фотон-элементарная частица света, обладающая волновыми свойствами.
Логично считать, что и другие частицы-электроны, нейтроны- обладают волновыми свойствами.
Формула для импульса фотона
была использована для других микрочастиц массой m, движущихся со скоростью v:
откуда
По де Бройлю, движение частицы, например, электрона, подобно волновому процессу с длиной волны λ
, определяемой формулой (4.4.3). Эти волны называют волнами де Бройля. Следовательно, частицы (электроны, нейтроны, протоны, ионы, атомы, молекулы) могут проявлять дифракционные свойства.
К.Дэвиссон и Л.Джермер впервые наблюдали дифракцию электронов на монокристалле никеля.
Может возникнуть вопрос: что происходит с отдельными частицами, как образуются максимумы и минимумы при дифракции отдельных частиц?
Опыты по дифракции пучков электронов очень малой интенсивности, то есть как бы отдельных частиц, показали, что при этом электрон не "размазывается" по разным направлениям, а ведет себя как целая частица. Однако вероятность отклонения электрона по отдельным направлениям в результате взаимодействия с объектом дифракции различная. Наиболее вероятно попадание электронов в те места, которые по расчету соответствуют максимумам дифракции, менее вероятно их попадание в места минимумов. Таким образом, волновые свойства присущи не только коллективу электронов, но и каждому электрону в отдельности.
4.4.2. Волновая функция и ее физический смысл
Так как с микрочастицей сопоставляют волновой процесс, который соответствует ее движению, то состояние частиц в квантовой механике описывается волновой функцией, зависящей от координат и времени:  . .
Если силовое поле, действующее на частицу, является стационарным, то есть не зависящим от времени, то ψ-функцию можно представить в виде произведения двух сомножителей, один из которых зависит от времени, а другой от координат:
В дальнейшем будем рассматривать только стационарные состояния; ψ-функция является вероятностной характеристикой состояния частицы. Поясним смысл этого утверждения.
Выделим в пространстве достаточно малый объем dV=dxdydz, в пределах которого значения ψ-функции можно считать одинаковыми. Вероятность нахождения dWв частицы в этом объеме пропорциональна объему и зависит от квадрата модуля ψ
-функции:
Отсюда следует физический смысл волновой функции:
Квадрат модуля волновой функции равен плотности вероятности, то есть отношению вероятности нахождения частицы в объеме к этому объему.
Интегрируя выражение (4.4.5) по некоторому объему V, находим вероятность нахождения частицы в этом объеме:
4.4.3. Соотношение неопределенностей
Одним из важных положений квантовой механики являются соотношения неопределенностей, предложенные В.Гейзенбергом.
Пусть одновременно измеряют положение и импульс частицы, при этом неточности в определениях абсциссы и проекции импульса на ось абсцисс равны соответственно Δx и Δрx.
В классической физике нет каких-либо ограничений, запрещающих с любой степенью точности одновременно измерить как одну, так и другую величину, то есть Δx→0 и Δрx→0.
В квантовой механике положение принципиально иное: Δx и Δрx , соответствующие одновременному определению x и рx, связаны зависимостью
Таким образом, чем точнее определена координата x (Δx→0), тем не менее точно определена проекция рx(Δpx→
±), и наоборот. Аналогично,
Формулы (4.4.8), (4.4.9) называют соотношениями неопределенностей.
Поясним их одним модельным экспериментом.
При изучении явления дифракции было обращено внимание на то, что уменьшение ширины щели при дифракции приводит к увеличению ширины центрального максимума. Аналогичное явление будет и при дифракции электронов на щели в модельном опыте. Уменьшение ширины щели означает уменьшение Δ
x (рис. 4.4.1), это приводит к большему "размазыванию" пучка электронов, то есть к большей неопределенности импульса и скорости частиц.
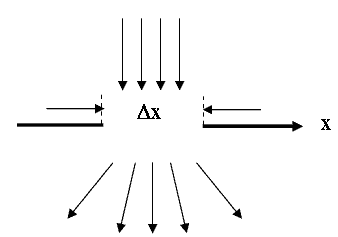
Рис. 4.4.1.Пояснение к соотношению неопределенности.
Соотношение неопределенностей можно представить в виде
где ΔE - неопределенность энергии некоторого состояния системы; Δt -промежуток времени, в точение которого оно существует. Соотношение (4.4.10) означает, что чем меньше время существования какого-либо состояния системы, тем более неопределенно его значение энергии. Энергетические уровни Е1, Е2 и т.д. имеют некоторую ширину (рис.4.4.2)), зависящую от времени пребывания системы в состоянии, соответствующем этому уровню.
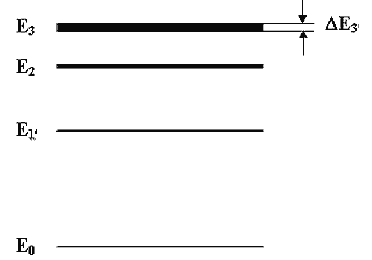
Рис. 4.4.2.Энергетические уровни Е1, Е2 и т.д. имеют некоторую ширину.
"Размытость" уровней приводит к неопределенности энергии ΔE излучаемого фотона и его частоты Δν при переходе системы с одного энергетического уровня на другой:
Это проявляется в уширении спектральных линий.
4.4.4.Уравнение Шредингера
Так как состояние микрочастицы описывают ψ
-функцией, то надо указать способ нахождения этой функции с учетом внешних условий. Это возможно в результате решения основного уравнения квантовой механики, предложенного Шредингером. Такое уравнение в квантовой механике постулируется так же, как в классической механике постулируется закон Ньютона.
Применительно к стационарным состояниям уравнение Шредингера может быть записано так:
или
 , ,
где m- масса частицы; 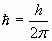 ; Е и Еn –ее полная и потенциальная энергии (потенциальная энергия определяется силовым полем, в котором находится частица, и для стационарного случая не зависит от времени) ; Е и Еn –ее полная и потенциальная энергии (потенциальная энергия определяется силовым полем, в котором находится частица, и для стационарного случая не зависит от времени)
Если частица перемещается только вдоль некоторой линии, например вдоль оси ОХ (одномерный случай), то уравнение Шредингера существенно упрощается и принимает вид
Одним из наиболее простых примеров на использование уравнения Шредингера является решение задачи о движении частицы в одномерной потенциальной яме.
4.4.5. Применение уравнения Шредингера к атому водорода. Квантовые числа
Описание состояний атомов и молекул с помощью уравнения Шредингера является достаточно сложной задачей. Наиболее просто она решается для одного электрона, находящегося в поле ядра. Такие системы соответствуют атому водорода и водородоподобным ионам (однократно ионизированный атом гелия, двукратно ионизированный атом лития и т.п.). Однако и в этом случае решение задачи является сложным, поэтому ограничимся лишь качественным изложением вопроса.
Прежде всего в уравнение Шредингера (4.4.12) следует подставить потенциальную энергию, которая для двух взаимодействующих точечных зарядов – e (электрон) и Ze (ядро), - находящихся на расстоянии r в вакууме, выражается следующим образом:
Состояние электрона в атоме характеризуется не одним, а несколькими квантовыми числами.
Первое из них - главное квантовое число n =1, 2, 3, ... Оно определяет уровни энергии электрона по закону
Это выражение является решением уравнения Шредингера и полностью совпадает с соответствующей формулой теории Бора (4.2.30)
На рис.4.4.3 показаны уровни возможных значений полной энергии атома водорода (Е1, Е2, Е3 и т.д.) и график зависимости потенциальной энергии Еn от расстояния r между электроном и ядром. С возрастанием главного квантового числа n увеличивается r (см.4.2.26), а полная (4.4.15) и потенциальная энергии стремятся к нулю. Кинетическая энергия также стремится к нулю. Заштрихованная область (Е>0) соответствует состоянию свободного электрона.
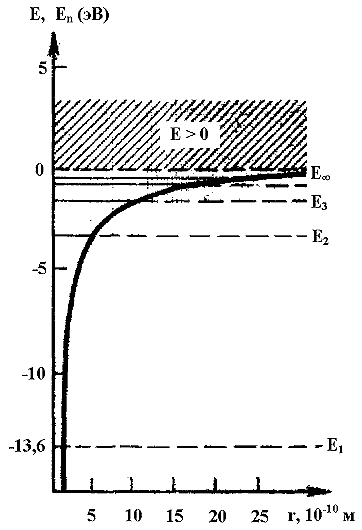
Рис. 4.4.3. Показаны уровни возможных значений полной энергии атома водорода
и график зависимости потенциальной энергии от расстояния r между электроном и ядром.
Второе квантовое число – орбитальное l, которое при данном n может принимать значения 0, 1, 2, …., n-1. Это число характеризует орбитальный момент импульса Li электрона относительно ядра:
Третье квантовое число – магнитное ml, которое при данном l принимает значения 0, ±1, ± 2, …, ±l; всего 2l+1 значений. Это число определяет проекции орбитального момента импульса электрона на некоторое произвольно выбранное направление Z:
Четвертое квантовое число – спиновое ms. Оно может принимать только два значения (±1/2) и характеризует возможные значения проекции спина электрона:
Состояние электрона в атоме с заданными n и l обозначают следующим образом: 1s, 2s, 2p, 3s и т.д. Здесь цифра указывает значение главного квантового числа, а буква – орбитальное квантовое число: символам s, p, d, f, соответствуют значения l=0, 1, 2. 3 и т.д.
|