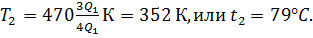Пример 8.
Определить плотность смеси газов: ν1 = 5 моль азота и ν2 = 10 моль кислорода, содержащихся
в баллоне при температуре t = 17°С
и давлении р = 2,5 МПа.
Решение. Согласно определению плотности как физической величины в данном случае имеем
где m1 и m2 – массы азота и кислорода соответственно, V – объем баллона.
Выразим массу каждого газа через количество вещества и молярную массу:
Для определения объема газов в баллоне воспользуемся уравнением Менделеева – Клапейрона для смеси газов:
(R – молярная газовая постоянная, Т – термодинамическая температура), откуда
Подставив выражения (2) и (3) в (1), получим
Проверим расчетную формулу (4):
Запишем ряд величин, входящих в (4), в единицах СИ: 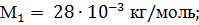
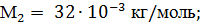
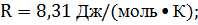

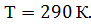
Вычислим искомую плотность
Пример 9.
Определить: 1) число атомов, содержащихся в 1 кг гелия, и 2) массу одного атома гелия.
Решение. Число молекул в данной массе газа
где m – масса газа, М – молярная масса, ν = m/M –
количество вещества, NA – постоянная Авогадро.
Поскольку молекулы гелия одноатомны, число атомов в данной массе газа равно числу молекул.
Запишем величины, входящие в формулу (1) в СИ:


Найдем искомое число атомов:
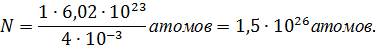
2. Для определения массы m1 одного атома достаточно массу газа разделить на число атомов в нём:
Подставив числовые значения величин и выполнив вычисление получим
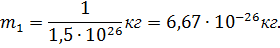
Пример 10.
Считая водяной пар массой m = 180 г при температуре t=127°C идеальным газом, определить:
1) внутреннюю энергию пара и 2) среднюю энергию вращательного движения одной молекулы этого пара.
Решение. Внутренняя энергия идеального газа есть полная кинетическая энергия всех молекул газа и выражается формулой
где i – число степеней свободы молекулы газа, М –
молярная масса, R – молярная газовая постоянная, Т – термодинамическая температура.
Проверим формулу (1):
Запишем числовые данные в СИ: m= 0,18 кг; Т = 400 К; M = 18·10-3 кг/моль; R = 8,31 Дж/(моль·К);
i = 6, так как молекула водяного пара трехатомная. Вычислим искомую внутреннюю энергию:
2. Известно, что на каждую степень свободы молекулы газа приходится, в среднем, энергия
где k – постоянная Больцмана. Вращательному движению каждой молекулы приписывается некоторое число степеней свободы iвр.
Это относится ко всем молекулам, кроме одиоатомных, для которых энергии вращательного движении заведомо равна нулю, как
для материальных точек, размещенных на оси вращения. Таким образом, энергия вращательного движения молекулы
Выпишем числовые значения величин в единицах СИ:
k = 1,38·10-23 Дж/К; iвр = З, так как вращательному движению трехатомной молекулы соответствуют три степени свободы.
Выполнив подстановку и вычисления, получим
Пример 11.
Кислород массой m = 320 г изобарно расширяется под давлением р = 2·105 Па от начальной температуры t1 = 20 С°,
поглощая в процессе расширения теплоту Q = 10 кДж. Определить: 1) работу расширения и 2) конечный объем, газа V2.
Решение.
Работа, совершаемая газом при неизменном давлении, выражается формулой
Из уравнения Менделеева – Клапейрона, записанного для начального и
конечного состояний газа (pV1 = mRT1/M, pV2 = mRT2/M), выразим неизвестные начальный V1 и конечный V2 объемы:
Подставив (2) и (3) в (1), получим
где М – молярная масса кислорода, R – молярная газовая постоянная, Т1 и Т1 – начальная и конечная температуры газа.
Из формулы теплоты изобарного процесса
где сp – удельная теплоемкость газа при постоянном давлении, выразим неизвестную разность температур
Известно, что
где i – число степеней свободы молекулы газа. Подставив (7) в (6), а затем результат в (4), получим
Выпишем в единицах СИ числовые значения величин: Q = 104 Дж; i = 5,так как молекула кислорода двухатомная.
По формуле (8) вычислим А:
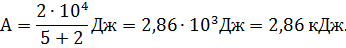
2. Для определения конечного объема V2, воспользуемся формулой (1), преобразовав которую, получим
Второе слагаемое в скобках, содержащее неизвестную величину V1 можем определить из уравнения Менделеева – Клапейрона для начального состояния газа.
Подставив в (9) правую часть уравнения (2), получим
Выразим в единицах СИ числовые значения величин, входящих в эту формулу: M = 32·10-3 кг/моль; Т = 293 К;
m = 0,32 кг; R = 9,31 Дж/(моль·К).
Вычислим искомый конечный объем:
Пример 12.
Каковы 1) средняя длина свободного пробега 〈l〉 и 2) средняя частота столкновений 〈z〉 молекул воздуха при температуре
t = 0 °С и давлении 1,01 Па? Принять эффективный диаметр молекулы воздуха равным d = 2,9·10-8 см.
Решение.
Средняя длина свободного пробега молекулы выражается формулой
где d – эффективный диаметр молекулы, n – концентрация молекул (отношение числа молекул к объему газа, в котором они заключены).
Для определения неизвестной концентрации молекул используем основное уравнение молекулярно – кинетической теории
Здесь р – давление газа; 〈wпост〉 – средняя энергия поступательного движения молекулы газа, равная
где k – постоянная Больцмана, Т – газа. термодинамическая температура газа.
Подставив (3) в (2), выразим из полученной формулы концентрацию молекул:
Подставив (4) в (1), получим
Проверим полученную расчетную формулу:
Выпишем величины, входящие в формулу в единицах СИ:
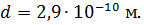
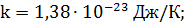
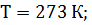
Вычислим искомую длину свободного пробега молекулы:
2. Средняя частота столкновений молекул газа связана с длиной свободного пробега соотношением
где 〈v〉 – средняя арифметическая скорость молекул. Её можно определить по формуле
где R – молярная газовая постоянная, μ – молярная масса воздуха.
Подставим (6) в (5) и после преобразований получим
Проверим формулу (7):
Выпишем в СИ недостающие для формулы (7) числовые данные: R = 8,31 Дж/(моль·К), М = 29·10-3 кг/моль.
Вычислим искомую частоту столкновений:
Пример 13.
Какова средняя квадратичная скорость молекул идеального газа при давлении p = 1,01·104 Па,
если плотность газа ρ = 0,2 кг/м3?
Решение.
Средняя квадратичная скорость молекул идеального газа выражается формулой
где R – молярная газовая постоянная, Т – термодинамическая температура газа, М – молярная масса.
Для определения неизвестных величин Т и М используем уравнение Менделеева – Клапейрона
откуда
где ρ – плотность газа.
Подставив RT/М по (2) в (1), получим
Проверим полученную расчетную формулу (3):
Вычислим искомую скорость молекул:
Пример 14.
Определить, при каком градиенте плотности углекислого газа через каждый квадратный метр поверхности почвы
продиффундирует в атмосферу в течение 1 ч масса газа m = 720 мг, если коэффициент диффузии D = 0,04 см2/с.
Решение.
Масса газа, переносимая в результате диффузии определяется законом Фика:
где D – коэффициент диффузии;Δρ/Δx – градиент плотности, т. е. изменение плотности, приходящееся
на 1 м толщины слоя почвы; S – площадь поверхности слоя; t – длительность диффузии.
Из (1) выразим искомый градиент плотности
Проверим формулу (2):
Выпишем числовые значения всех величин, входящих в формулу (2), в единицах СИ:
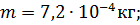

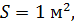
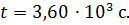 Вычислим градиент плотности:
Вычислим градиент плотности:
Отрицательное значение градиента плотности соответствует сущности процесса диффузии: зависимость плотности от расстояния в направлении
движения диффундирующей массы выражается убывающей функцией, градиент которой - отрицательная величина.
Пример 15.
Определить количество теплоты, теряемое через бетонные стены родильного отделения фермы КРС площадью 50 м2 за время t = 1 мин,
если в помещении отделения температура стены t1 = 15°С, а снаружи t2 = -10°С. Толщина стен Δ х = 25 см.
Решение.
Количество теплоты, передаваемое теплопроводностью, выражается законом Фурье:
где λ – теплопроводность материала стены; ΔT/Δx – градиент температуры,
т. е. изменение температуры, приходящееся на 1 м толщины стены; S – площадь поверхности стены; t – время передачи тепла.
Проверим формулу (1):
Выразим числовые значения всех величин в СИ:
ΔT = t2-t1 = T2-T1 = -10°C-15°C = -25°C = -25K;
Δх=0,25 м; S=50 м2;
t=60 с;
λ=0,817 Дж/(м·с·К) (см. прил., табл. 6).
Подставим указанные значения в формулу (1) и вычислим Q:
Пример 16.
Воздух, взятый при температуре t1 = 0°С, был адиабатно сжат так, что его объем уменьшился в три раза. Определить температуру воздуха после сжатия.
Решение.
Зависимость между температурой и объемом при адиабатном сжатии выражается уравнением Пуассона:
Где T1,V1 – соответственно термодинамическая температура и объем до сжатия воздуха;
Т2, V2 – те же величины после сжатия воздуха;
γ = Cp/Cv – отношение теплоемкости газа при постоянном давлении Cp
к теплоемкости газа при постоянном объеме Cv.
Из теории теплоемкостей газов известно, что
где i – число степеней свободы молекулы газа. Так как воздух – газ двухатомный, то i = 5 и, следовательно,
Из формулы (1) получим
Подставим числовые значения (Т1 = 273 К, γ = 1,4; V1/V2 = 3 ) в (2):
Прологарифмируем обе части полученного равенства:
По значению 1g Т2, пользуясь таблицей антилогарифмов, найдем T2 = 424 К, или
Пример 17.
Нагреватель тепловой машины, работающей по циклу Карно, имеет температуру t1 = 197 °C..
Определить температуру охладителя, если 3/4 теплоты, полученной от нагревателя, газ отдает охладителю.
Решение.
Термический к. п. д. тепловой машины, работающей по циклу Карно, выражается формулой
или, как и для любого цикла,
где Т1 и Т2 – соответственно термодинамические температуры нагревателя и охладителя; Q1 – теплота,
полученная газом от нагревателя; Q1 – теплота, отданная газом охладителю.
Приравняв правые части формул (1) и (2), получим
После простых преобразований уравнение (3) примет вид
откуда
Числовые значения
 , ,
 (согласно условию), подставим в (5): (согласно условию), подставим в (5):
| 

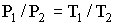

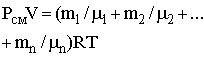
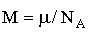
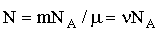
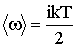
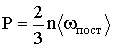
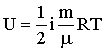
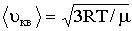
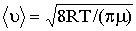
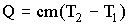
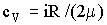
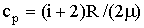
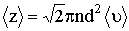

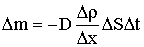

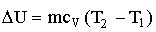
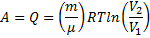
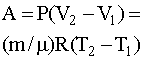
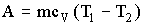
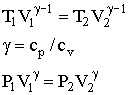
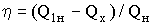
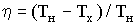
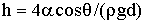
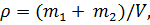
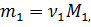
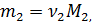
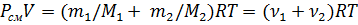
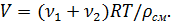

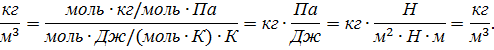
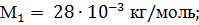
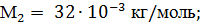
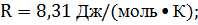

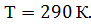
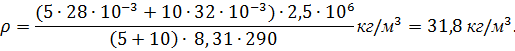
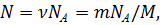


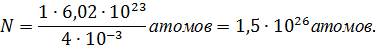
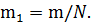
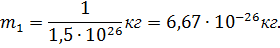
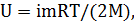
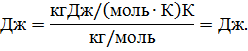
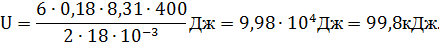
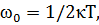
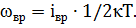
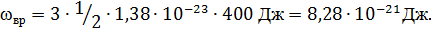

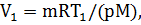
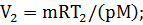
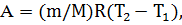
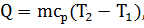



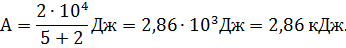
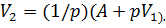
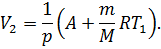
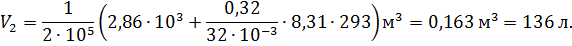

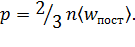
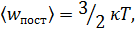
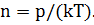
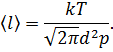
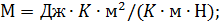
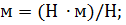
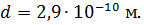
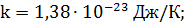
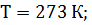
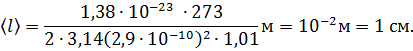
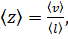
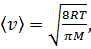
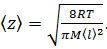

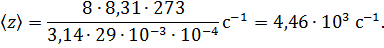
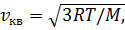
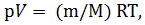
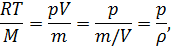

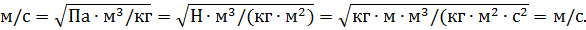
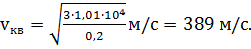


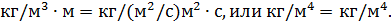
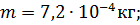

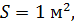
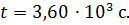 Вычислим градиент плотности:
Вычислим градиент плотности:
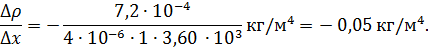


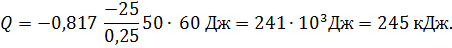
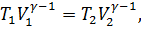

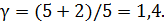
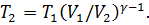
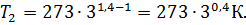
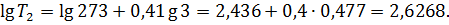
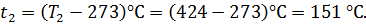

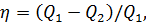



 ,
,
 (согласно условию), подставим в (5):
(согласно условию), подставим в (5):