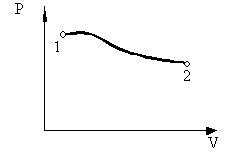
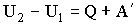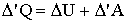Обычно вместо работы внешних сил над системой A' рассматривают работу А = - A', совершаемую системой над внешними телами. Тогда уравнение (2.1.3) можно привести к виду:
Уравнение (2.1.4) выражает закон сохранения энергии и представляет собой содержание первого начала термодинамики: количество тепла, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами. Внутреннюю энергию измеряют, как и работу, в системе СИ в джоулях. Есть также особая единица - 1 калория, которая равна количеству тепла, необходимому для нагревания 1 г воды от 19,5 до 20,5 °С. Опытным путем было установлено, что 1 кал = 4,18 Дж. Величина I = 4,18 Дж/кал называется механическим эквивалентом тепла. При вычислении совершенной системой работы или полученного системой тепла приходится разбивать рассматриваемый процесс на ряд элементарных процессов, каждый из которых соответствует малому изменению параметров системы. Уравнение (2.1.4) для элементарного процесса имеет вид:
где ΔQ - элементарное количество тепла, Δ'A - элементарная работа, ΔU - приращение внутренней энергии. Надо иметь в виду, что Δ'Q и Δ'A нельзя рассматривать как приращения величин Q и А. В действительности величина совершенной телом работы и количество полученного системой тепла зависят от пути перехода системы из одного состояния в другое. Следовательно, ни А, ни Q не являются функциями состояния, в силу чего нельзя говорить о запасе тепла или работы, которыми обладала бы система в различных состояниях. Данное обстоятельство отмечено в уравнении (2.1.5) штрихом при знаке Δ. При этом ΔU - это действительно приращение внутренней энергии системы. При переходе к бесконечно малым величинам уравнение (2.1.5) будет иметь вид:
где dU - полный дифференциал. 2.1.4. Работа, совершаемая телом
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
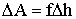 | (2.1.7) |
где f - сила, с которой газ действует на поршень.
Уравнение (2.1.7) может быть записано так:
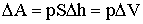 | (2.1.8) |
где р - давление газа, S - площадь поршня, ΔV = SΔh - изменение объема газа.
При сжатии газа направления перемещения и силы, с которой газ действует на поршень, противоположны, вследствие чего работа будет отрицательна.
Если давление газа постоянно, работа при изменении объема равна:
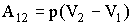 | (2.1.9) |
В общем случае работу следует вычислять так:
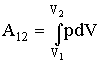 | (2.1.10) |
Уравнение первого начала термодинамики для этого случая можно записать так:
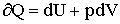 | (2.1.11) |
2.1.5. Температура
Если несколько соприкасающихся тел находятся в состоянии теплового равновесия, т.е. не обмениваются энергией путем теплопередачи, то этим телам приписывается одинаковая температура. Если при установлении теплового контакта одно из тел передает другому энергию, то первому тему приписывают температуру, большую, чем у второго тела.
Приведем тело, выбранное нами для термометрических измерений (термометрическое тело), в тепловое равновесие с тающим льдом и припишем телу в этом случае температуру 0°С. В качестве термометрических тел выбирают, например, спирт или ртуть. Пусть в качестве признака изменения температуры выбрано изменение объема тела, и значение объема, соответствующее 0° С, обозначим V0. Затем приведем то же тело в тепловое равновесие с кипящей при атмосферном давлении водой, припишем телу в этом случае температуру 100°С, и определим соответствующий объем V100. Принимая, что объем изменяется с температурой линейно, можно состоянию тела с произвольным объемом V приписать температуру:
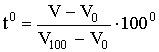 | (2.1.12) |
Установленная таким образом температурная шкала называется шкалой Цельсия.
2.1.6. Уравнение состояния идеального газа.
Экспериментальные газовые законы.
Идеальный газ - это такой газ, внутренняя энергия которого определяется только кинетической энергией составляющих его молекул. Считают также, что в этом случае объем молекул равен нулю. Потенциальной энергией взаимодействия между молекулами и внутримолекулярной энергией можно пренебречь при условии, что такой газ имеет низкую плотность и находится при не слишком высоких температуре и давлении. Этому условию обычно удовлетворяют многие газы при нормальных условиях.
Состояние некоторой массы газа определяется значениями трех параметров: давления, объема и температуры. Эти параметры закономерно связаны друг с другом, так что изменение одного из них влечет за собой изменение других. Такая связь может быть задана аналитически в виде функции:
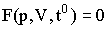 | (2.1.13) |
Соотношения, подобные (2.1.13), называются уравнениями состояния тела. Если разрешить (2.1.13) относительно какого-либо из параметров, например р, уравнение состояния примет вид:
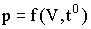 | (2.1.14) |
Например, закон Бойля-Мариотта гласит, что при данной массе газа произведение давления на объем есть величина постоянная:
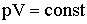 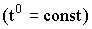 | (2.1.15) |
Совокупность состояний, отвечающих одной и той же температуре, изображается гиперболой на p - V диаграмме (Рис. 2.1.3).
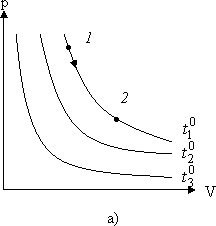
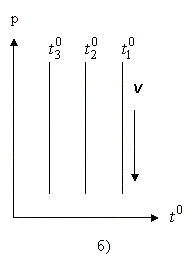
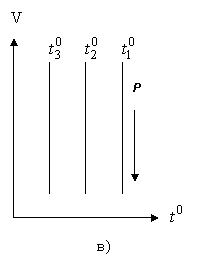
Рис. 2.1.3. Диаграммы изотермических процессов
Каждому значению температуры соответствует своя кривая - изотерма. При изотермическом процессе точка, изображающая состояние газа, перемещается по изотерме.
Закон Гей-Люссака гласит, что при неизменном давлении объем данной массы газа меняется линейно с температурой:
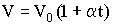 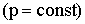 | (2.1.16) |
Процесс (2.1.16) - изобарический (Рис. 2.1.4а).
Аналогичная зависимость имеется для давления при постоянном объеме (закон Шарля):
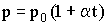 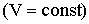 | (2.1.17) |
Это - изохорический процесс (Рис. 2.1.4б). В уравнениях (2.1.16) и (2.1.17) V0 - объем при 0°С, р0 - давление при 0°С. Коэффициент 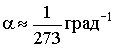 .
.


Рис. 2.1.4. Изобарический (а) и изохорический (б) процессы в газах
Все изобары и изохоры пересекают ось температур в одной и той же точке, определяемой из условия: 1 + αt = 0,откуда следует:
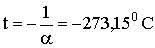
Сместив начало отсчета температур в эту точку, можно перейти от шкалы температур по Цельсию к температурной шкале Кельвина, или абсолютной температурной шкале. В соответствии с определением абсолютной шкалы между ней и шкалой Цельсия имеется соотношение:
 | (2.1.18) |
Температура, равная 0 К, называется абсолютным нулем. Переходя в соотношениях (2.1.16) и (2.1.17) к абсолютной температуре, получим:
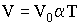  | (2.1.19) |
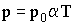 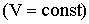 | (2.1.20) |
Используя (2.1.19) и (2.1.20), можно записать:
 | (2.1.21) |
 | (2.1.22) |
Газ, который точно следует уравнениям (2.1.15), (2.1.21) и (2.1.22), называется идеальным. Всякий реальный газ по мере убывания его плотности все больше приближается по свойствам к идеальному газу. Такие газы, как воздух, азот, кислород, при комнатной температуре и атмосферном давлении весьма близки к идеальному газу. Особенно близки по свойствам к идеальному газу гелий и водород.
Объединяя уравнения Бойля-Мариотта и Гей-Люссака, можно найти уравнение состояния идеального газа. Для этого возьмем на диаграмме (p,V) два произвольных состояния, определяемых параметрами (p1,V1,Т1) и (p2,V2,Т2) (Рис. 2.1.5).

Рис. 2.1.5. К выводу уравнения Клапейрона
Рассмотрим переход из 1 в 2, состоящий из изотермы 1 - 1' и изохоры 1' - 2. Состояния 1 и 1' лежат на одной изотерме. Следовательно, согласно (2.1.15), выполняется:
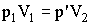 | (2.1.23) |
Состояния 1' и 2 лежат на одной изохоре, поэтому, согласно (2.1.22), имеем:
 | (2.1.24) |
Исключая из этих уравнений р', получим:
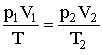 | (2.1.25) |
Поскольку состояния 1 и 2 были взяты произвольно, можно утверждать, что для любого состояния будет выполняться:
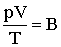 | (2.1.26) |
где В - величина, постоянная для данной массы газа.
Согласно закону Авогадро, килограмм-молекулы всех газов занимают при одинаковых условиях одинаковый объем. При нормальных условиях объем одного киломоля любого газа равен 22,4 м³/кмоль. Отсюда следует, что в случае, когда количество газа равно одному киломолю, величина В в (2.1.26) будет одинакова для всех газов. Обозначая соответствующую киломолю величину В = R, а объем киломоля через Vкм, уравнение (2.1.26) можно записать в виде:
 | (2.1.27) |
Это уравнение называется уравнением Клапейрона. Величина R называется универсальной газовой постоянной. Ее значение можно вычислить, подставляя в (2.1.27) давление и температуру при нормальных условиях (1 атм и 273°С) и Vкм = 22,4 м³/кмоль:

От уравнения для одного киломоля легко перейти к уравнению для любой массы газа m, приняв во внимание, что при одинаковых температуре и давлении z киломолей газа будут занимать в z больший объем, чем один киломоль: V = zVкм. Умножив (2.1.27) на z = m/μ (μ - масса киломоля), получим:
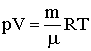 | (2.1.28) |
Это и есть уравнение состояния идеального газа.
2.1.7. Уравнение кинетической
теории газов для давления
Поставим задачу о вычислении давления газа на стенки сосуда исходя из молекулярно-кинетической модели газа, согласно которой газ - это совокупность одинаковых, хаотически движущихся, не взаимодействующих друг с другом на расстоянии молекул. Размеры молекул столь малы, что их суммарным объемом можно пренебречь в сравнении с объемом сосуда. Считается, что подавляющую часть времени молекула движется свободно, изредка претерпевая упругие соударения с другими молекулами или со стенками сосуда. Это - модель идеального газа.
При ударе о стенку сосуда молекула сообщает ей импульс, численно равный изменению импульса молекулы. Все направления движения равновероятны, поскольку давление газа на стенки сосуда всюду одинаково.
Скорости молекул могут быть самыми различными и должны меняться при каждом соударении, причем они могут как возрастать, так и убывать. Это следует из того, что кинетическая энергия двух молекул до и после соударения должна быть одинакова. Следовательно, возрастание скорости одной молекулы должно сопровождаться уменьшением скорости другой.
Введем некоторые упрощения:
- Пусть молекулы движутся только вдоль трех взаимно перпендикулярных направлений. Если газ содержит N молекул, то в любой момент времени вдоль каждого из направлений будет двигаться N/3 молекул, причем половина из них (N/6) движется вдоль данного направления в одну сторону, половина - в другую (Рис. 2.1.6).

Рис. 2.1.6. Равнораспределение молекул
- Всем молекулам припишем одинаковое значение скорости v.
Вычислим импульс, сообщаемый стенке сосуда ударяющейся об нее молекулой. До удара о стенку импульс молекулы направлен по внешней нормали к площадке ΔS и равен по величине mv (Рис. 2.1.7).
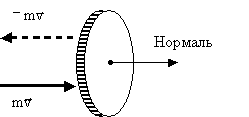
Рис. 2.1.7. Изменение импульса молекулы при упругом соударении со стенкой
В результате удара импульс меняет знак. Таким образом, приращение импульса молекулы составляет:
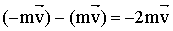 | (2.1.29) |
По третьему закону Ньютона стенка получит при ударе импульс  , имеющий направление нормали. За время Δt до элемента стенки ΔS долетят все движущиеся к нему молекулы, заключенные в объеме цилиндра с основанием ΔS и высотой vΔt. Число этих молекул равно:
, имеющий направление нормали. За время Δt до элемента стенки ΔS долетят все движущиеся к нему молекулы, заключенные в объеме цилиндра с основанием ΔS и высотой vΔt. Число этих молекул равно:
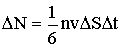 | (2.1.30) |
где где n - концентрация (число молекул в единице объема).
Умножив число ударов (2.1.30) на импульс (2.1.29), сообщаемый стенке при каждом ударе, получим суммарный импульс, сообщаемый элементу стенки за время Δt:
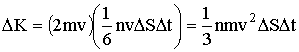 | (2.1.31) |
Относя этот импульс к промежутку времени Δt, получим силу, действующую на элемент стенки:
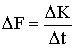 | (2.1.32) |
Эта величина, отнесенная к единице площади стенки, и есть искомое давление:
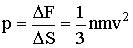 | (2.1.33) |
Учитывая, что кинетическая энергия поступательного движения молекулы равна 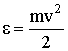 , выражение для давления примет вид:
, выражение для давления примет вид:
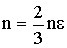 | (2.1.34) |
Откажемся сейчас от предположения о равенстве скоростей молекул. Пусть n1 молекул имеют скорости, практически равные v1, n2 молекул имеют скорости, практически равные v2,..., и вообще, ni молекул имеют скорости, практически равные vi. Очевидно, что выполняется:
 | (2.1.35) |
Зная распределение молекул по скоростям, можно найти среднее значение скорости молекул. Для этого нужно сложить скорости всех молекул и разделить полученный результат на n:
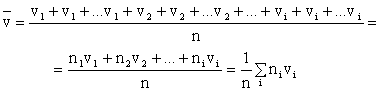 | (2.1.36) |
При записи (2.1.36) учитывалось, что всего есть n1 слагаемых со скоростью v1, n2 слагаемых со скоростью v2 и т.д. Проведя аналогичные рассуждения для кинетической энергии поступательного движения молекул, можно найти среднее значение их энергии:
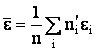 | (2.1.37) |
где  - число молекул, обладающих энергией, практически равной εi. Из (2.1.37) следует, что суммарная кинетическая энергия молекул, содержащихся в единице объема, равна
- число молекул, обладающих энергией, практически равной εi. Из (2.1.37) следует, что суммарная кинетическая энергия молекул, содержащихся в единице объема, равна  - произведению числа молекул на среднюю энергию одной молекулы.
- произведению числа молекул на среднюю энергию одной молекулы.
Повторяя все рассуждения для давления одной частицы, но заменяя скорость на среднюю скорость, а кинетическую энергию - на среднюю кинетическую энергию, формулу для давления (2.1.33) следует записать так:
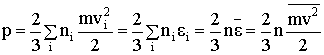 | (2.1.38) |
Уравнение (2.1.38) - это основное уравнение кинетической теории газов: давление равно двум третям кинетической энергии поступательного движения молекул, заключенных в единице объема.
Температура Т пропорциональна давлению идеального газа при постоянном объеме. С другой стороны, согласно (2.1.38), давление пропорционально средней энергии кинетического поступательного движения молекулы. Поэтому должно выполняться 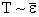 . Чтобы найти точное соотношение, умножим уравнение (2.1.38) на объем киломоля:
. Чтобы найти точное соотношение, умножим уравнение (2.1.38) на объем киломоля:
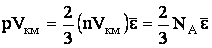 | (2.1.39) |
и сопоставим (2.1.39) с уравнением для идеального газа pVкм = RT. Отсюда следует, что:
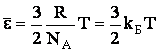 | (2.1.40) |
где 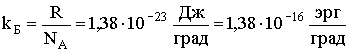 - постоянная Больцмана.
- постоянная Больцмана.
Следовательно, абсолютная температура есть величина, пропорциональная средней энергии поступательного движения одной молекулы. Этот вывод справедлив не только для газов, но и для вещества в любом агрегатном состоянии. Примечательно, что средняя энергия не зависит от массы молекулы.
Заменив в уравнении идеального газа R = NAkБ и учитывая, что концентрация газа 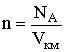 получим важную формулу:
получим важную формулу:
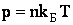 | (2.1.41) |
Если имеется смесь нескольких газов, разные по массе молекулы будут иметь различную среднюю скорость, но средняя энергия молекул будет одна и та же. Давление в этом случае будет равно:
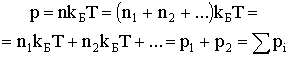 | (2.1.42) |
Здесь n1, n2, и т.д. - концентрации молекул первого, второго и т.д. сорта. Тем самым оказывается, что выполняется закон Дальтона: общее давление смеси идеальных газов разного сорта равно сумме парциальных давлений газов, образующих смесь. Парциальным называют давление, обусловленное молекулами какого-либо одного сорта, при условии, что только эти молекулы присутствуют в сосуде в том количестве, в котором они содержались в смеси.
2.1.8. Равнораспределение энергии
по степеням свободы
В полученном ранее выражении:
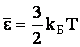 | (2.1.43) |
учитывалась только энергия поступательного движения молекулы. Однако наряду с поступательным движением возможны также вращение молекулы и колебания атомов, входящих в состав молекулы. Эти виды движения также связаны с запасом энергии. Тогда общая энергия сложной молекулы определяется числом ее степеней свободы.
Числом степеней свободы механической системы называется число независимых координат, определяющих ее положение и конфигурацию в пространстве.
Так, положение в пространстве МТ (частицы газа, состоящего из атомов одного сорта) может быть полностью задано тремя координатами. Представим энергию поступательного движения такой частицы в виде суммы трех слагаемых - кинетических энергий движения молекулы по трем взаимно перпендикулярным направлениям:
 | (2.1.44) |
где vx, vy, vz - составляющие скорости молекулы по трем осям координат.
Полная хаотичность движения молекулы позволяет считать, что средние значения кинетических энергий по трем направлениям равны друг другу:
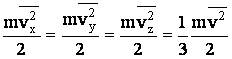 | (2.1.45) |
Сопоставляя (2.1.43) и (2.1.45), получаем, что на одну степень поступательного движения частицы приходится энергия, равная:
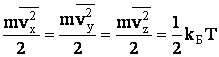 | (2.1.46) |
Если бы, например, существовал такой гипотетический одноатомный "одномерный" газ, все частицы которого обладали бы способностью двигаться только вдоль одной прямой, то средняя кинетическая энергия молекулы такого газа равнялась бы 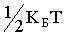 .
.
Естественно предположить, что если бы молекула газа обладала бы еще какими-нибудь степенями свободы, то и на каждую из них приходится среднее значение кинетической энергии, равное 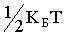 . В классической статистической физике Л. Больцманом доказана теорема: если система молекул находится в тепловом равновесии при температуре Т, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна
. В классической статистической физике Л. Больцманом доказана теорема: если система молекул находится в тепловом равновесии при температуре Т, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна 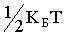 . Эта теорема называется законом равномерного распределения кинетической энергии по степеням свободы.
. Эта теорема называется законом равномерного распределения кинетической энергии по степеням свободы.
В отношении своей внутренней энергии двух- и многоатомные газы отличаются от одноатомных числом степеней свободы своих молекул. Следовательно, для вычисления внутренней энергии газа надо уметь определять число степеней свободы.
Рассмотрим простейший случай двухатомной молекулы (Н2, О2, N2, CO, NO, …) (Рис. 2.1.8).
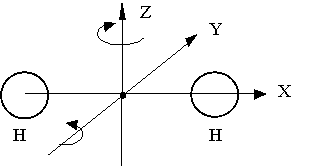
Рис. 2.1.8. Модель двухатомной молекулы
Если расстояние между атомами не меняется (такие молекулы называются жесткими), то такая система, в общем случае, будет иметь шесть степеней свободы. Действительно, положение и конфигурация такой молекулы определяется: тремя координатами ее центра масс, которые задают поступательное движение молекулы как целого, и тремя координатами, определяющими возможные вращения молекулы вокруг каждой из трех осей X, Y, Z.
Однако опыт и теория показывают, что вращение таких молекул вокруг оси Х, на которой лежат центры атомов, может быть возбуждено лишь при высоких температурах. При обычных температурах вращение вокруг этой оси не происходит. Это можно также объяснит тем обстоятельством, что при вращении вокруг данной оси момент инерции молекулы - наименьший, и энергетический вклад от такого движения должен быть минимальным.
Следовательно, число степеней свободы жесткой двухатомной молекулы равно 5: 3 - поступательных + 2 - вращательных.
Атомы и молекулы не всегда жестко связаны друг с другом, они могут совершать колебания относительно друг друга. Тогда потребуется еще одна координата для определения конфигурации молекулы - расстояние между атомами.
Таким образом, для двухатомной молекулы с упругой связью между атомами существует 6 степеней свободы: 3 - поступательных + 2 - вращательных + 1 - колебательная. Во многих случаях колебательные движения атомов не возбуждаются. Но если они существуют, и если их амплитуды малы по сравнению с расстоянием между атомами, то такие колебания можно считать гармоническими. Атомы в этом случае являются гармоническими осцилляторами. Однако осциллятор обладает не только кинетической, но и потенциальной энергией. Для гармонического осциллятора, как известно из механики, средние значения кинетической и потенциальной энергии равны между собой. Следовательно, если возбуждены гармонические колебания атомов, то по закону равнораспределения на каждую колебательную степень свободы молекулы приходится 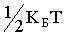 в виде кинетической энергии и
в виде кинетической энергии и 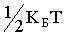 в виде потенциальной энергии. Поэтому энергия, приходящаяся на одну колебательную степень свободы молекулы, равна kБТ.
в виде потенциальной энергии. Поэтому энергия, приходящаяся на одну колебательную степень свободы молекулы, равна kБТ.
Если молекула состоит из n атомов, не жестко связанных, то она имеет 3n степеней свободы (каждый атом имеет 3 степени свободы). Из этого числа 3 - поступательных + 3 - вращательных, за исключением случая, когда атомы расположены на одной прямой, - тогда вращательных степеней свободы - 2 (как у двухатомной молекулы).
На Рис. 2.1.9 приведена модель трехатомной молекулы.

Рис. 2.1.9. Модель трехатомной молекулы
Таким образом, нелинейная n - атомная молекула в общем случае может иметь (3n - 6) колебательных степеней свободы, а линейная - (3n - 5).
Таким образом, средняя энергия молекулы должна равняться:
 | (2.1.47) |
где i - сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:
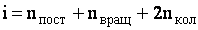 | (2.1.48) |
Для молекул с жесткой связью между атомами i совпадает с числом степеней свободы молекулы.
2.1.9. Внутренняя энергия
и теплоемкость идеального газа
Вследствие того, что молекулы идеального газа не взаимодействуют на расстоянии, внутренняя энергия такого газа складывается из энергий отдельных молекул. Следовательно, внутренняя энергия одного киломоля идеального газа будет равна произведению числа Авогадро на среднюю энергию одной молекулы:
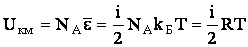 | (2.1.49) |
Внутренняя энергия произвольной массы газа m будет равна внутренней энергии одного моля, умноженной на число киломолей газа, содержащихся в массе m:
 | (2.1.50) |
Теплоемкостью какого-либо тела называется количество тепла, которое нужно сообщить телу, чтобы повысить его температуру на один градус:
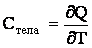 | (2.1.51) |
Теплоемкость одного киломоля обозначается буквой С и имеет размерность Дж/град·кмоль. Теплоемкость с единицы массы называется удельной теплоемкостью и имеет размерность Дж/град·кг. Между удельной теплоемкостью и теплоемкостью одного киломоля есть очевидное соотношение:
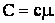 | (2.1.52) |
где μ - масса киломоля.
Величина теплоемкости зависит от условий, при которых происходит нагревание тела. Наибольший интерес представляют два случая:
- нагревание тела производится при постоянном объеме (СV);
- нагревание тела производится при постоянном давлении (Ср).
Если нагревание тела производится при постоянном объеме, тело не совершает работы над внешними телами и, согласно первому началу термодинамики (2.1.11), все тепло идет на приращение внутренней энергии тела:
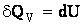 | (2.1.53) |
Из (2.1.53) следует, что теплоемкость любого тела при постоянном объеме равна:
 | (2.1.54) |
Подставляя в (2.1.54) соотношение (2.1.49), получим выражение для теплоемкости кило-моля идеального газа:
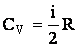 | (2.1.55) |
Отсюда следует, что теплоемкость киломоля идеального газа, измеренная при постоянном объеме, не зависит от параметров состояния газа. Исходя из (2.1.55), в этом случае можно представить внутреннюю энергию так:
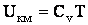 | (2.1.56) |
Если нагревание тела производится при постоянном давлении, то газ будет расширяться, совершая над внешними телами положительную работу. Следовательно, для повышения температуры газа на один градус в этом случае потребуется больше тепла, чем при нагревании при постоянном объеме, - часть тепла будет затрачена на совершение газом работы.
Напишем уравнение первого начала термодинамики (2.1.11) для киломоля газа:
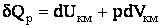 | (2.1.57) |
Разделив (2.1.57) на dT, получим, с учетом (2.1.54), выражение для теплоемкости кило моля идеального газа при постоянном давлении:
 | (2.1.58) |
В соответствии с уравнением состояния идеального газа (2.1.27) 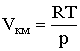 и с помощью (2.1.58), имеем:
и с помощью (2.1.58), имеем:
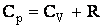 | (2.1.59) |
Таким образом, работа, которую совершает киломоль идеального газа при повышении его температуры на один градус при постоянном давлении, оказывается равной универсальной газовой постоянной. С учетом формулы (2.1.55) соотношение (2.1.59) примет вид:
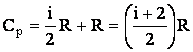 | (2.1.60) |
Поделив (2.1.60) на (2.1.55), найдем характерное для каждого газа отношение γ = Ср/СV:
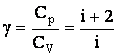 | (2.1.61) |
В Табл. 2.1.1 приводятся значения Ср, CV и γ для различных молекул, в Табл. 2.1.2 сопоставлены результаты теории с экспериментом. Теоретические значения получены в предположении, что молекулы являются жесткими, экспериментальные данные приводятся для температур, близких к комнатным.
Таблица 2.1.1
| Молекула | Характер связи между атомами | Число степеней свободы | i | CV | Cp | γ | ||
|---|---|---|---|---|---|---|---|---|
| пос- тупат. | вра- щат. | ко- леб. | ||||||
| Одноатомная | - | 3 | - | - | 3 | 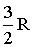 | 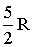 | 1,67 |
| Двухатомная | Жесткая | 3 | 2 | - | 5 | 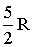 | 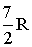 | 1,40 |
| Двухатомная | Упругая | 3 | 2 | 1 | 7 | 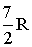 |  | 1,29 |
| С числом атомов три и более | Жесткая | 3 | 3 | - | 6 | 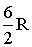 | 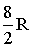 | 1,33 |
Таблица 2.1.2
| Газ | Количество атомов в молекуле | СV, 10³ Дж/град·кмоль | Сp, 10³ Дж/град·кмоль | γ | |||
|---|---|---|---|---|---|---|---|
| теор. | эксп. | теор. | эксп. | теор. | эксп. | ||
| Гелий (Не) | 1 | 12,5 | 12,5 | 20,8 | 20,9 | 1,67 | 1,67 |
| Кислород (О2) | 2 | 20,8 | 20,9 | 29,1 | 28,9 | 1,40 | 1,40 |
| Окись углерода (СО) | 2 | 20,8 | 21,0 | 29,1 | 29,3 | 1,40 | 1,40 |
| Пары воды (Н2О) | 3 | 25,0 33,2*) | 27,8 | 33,2 41,5*) | 36,2 | 1,33 1,25*) | 1,31 |
*)Для i = 8, т.е. в предположении, что имеется дополнительно одна колебательная степень свободы.
Согласно классической теории, теплоемкость не должна зависеть от температуры. Однако на Рис. 2.1.10 такая зависимость для молекул водорода существует.
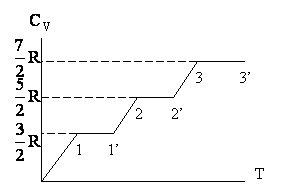
Рис. 2.1.10. Температурная зависимость теплоемкости водорода
Нет температурной зависимости только в определенных температурных областях, причем в таких областях теплоемкость имеет значения, соответствующие различному числу степеней свободы молекулы. Так, на участке 1 - 1' СV = 3/2R, что означает, что молекула ведет себя как система, обладающая только поступательными степенями свободы. На участке 2 - 2' СV = 5/2R, следовательно, при температурах, соответствующих данному интервалу, у молекулы, в дополнение к проявляющимся при более низких температурах трем поступательным степеням свободы, добавляются еще две вращательные. Наконец, при достаточно высоких температурах Cv = 7/2R, что свидетельствует о наличии при этих температурах колебательных движений в молекуле. В промежутке между названными интервалами теплоемкость с температурой монотонно возрастает, что говорит о том, что в новый вид движения вовлекаются не все молекулы сразу. Причины такого поведения могут быть объяснены только на основе квантовомеханического подхода.
2.1.10. Уравнение адиабаты идеального газа
Адиабатическим называется такой процесс, который протекает без теплообмена с окружающей средой. Для его описания подставим в уравнение первого начала термодинамики (2.1.11) выражение для внутренней энергии (2.1.58), взятое для идеального газа с массой m:
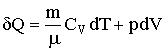 | (2.1.62) |
Так как для адиабатического процесса δQ = 0, то должно выполняться:
 | (2.1.63) |
Используя уравнение состояния идеального газа, получим 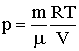 . Подставляя это выражение в (2.1.63), после преобразования имеем:
. Подставляя это выражение в (2.1.63), после преобразования имеем:
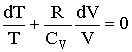 | (2.1.64) |
Данное соотношение можно представить так:
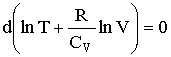 | (2.1.65) |
откуда следует, что при адиабатическом процессе выполняется:
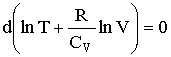 | (2.1.66) |
Из (2.1.59) следует, что Ср - СV = R. Поэтому, вводя величину
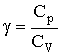 | (2.1.67) |
можно представить: 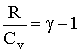 , тогда уравнение (2.1.66) после потенцирования примет вид:
, тогда уравнение (2.1.66) после потенцирования примет вид:
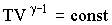 | (2.1.68) |
Это – уравнение адиабаты идеального газа в переменных Т и V. От этого уравнения можно перейти к уравнению в переменных p и V, используя уравнение состояния идеального газа в виде 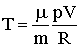 . Тогда уравнение (2.1.68) можно записать:
. Тогда уравнение (2.1.68) можно записать:
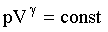 | (2.1.69) |
Это - уравнение адиабаты идеального газа в переменных p и V, называемое также уравнением Пуассона.
Во всех рассуждениях предполагалось, что состояние идеального газа в каждый момент времени характеризуется определенными значениями параметров p и Т, т.е. что рассматриваемый процесс является равновесным. Однако равновесным может быть процесс, протекающий очень медленно. Вместе с тем, поскольку в природе не существует совершенно не проводящих тепло веществ, количество тепла, которым система обменивается со своим окружением, будет тем меньше, чем меньшее время длится процесс. Следовательно, близкими к адиабатическим могут быть только быстро протекающие процессы, например, сжатие и расширение газа при распространении через него звуковой волны.
2.1.11. Политропические процессы
Все рассмотренные ранее процессы - это частные случаи политропического процесса. Политропическим называется такой процесс, при котором давление и объем идеального газа связаны соотношением:
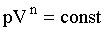 | (2.1.70) |
где n может принимать значения от - ∞ до + ∞. В Табл.2.1.3 указаны значения числа n, при которых уравнение (2.1.1) соответствует одному из известных процессов.
Таблица 2.1.3
| n | Процесс | n | Процесс |
|---|---|---|---|
| 0 | Изобарический | γ | Адиабатический |
| 1 | Изотермический | ± ∞ | Изохорический |
Первые три строки очевидны. Чтобы убедиться в справедливости четвертой строки, запишем уравнение политропы (2.1.70) для двух произвольных состояний:
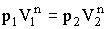 | (2.1.71) |
Извлечем из (2.1.71) корень n - степени:
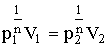 | (2.1.72) |
Устремляя n → ± ∞, придем к условию:
 | (2.1.73) |
которое характеризует изохорический процесс.
2.1.12. Барометрическая формула
Атмосферное давление на какой-либо высоте h обусловлено весом вышележащих слоев газа. Пусть на этой высоте давление равно р. Тогда давление на высоте h + dh равно р + dp, причем если dh > 0, то dp < 0, так как вес вышележащих слоев атмосферы, а, следовательно, и давление с высотой убывают. Разность давлений р и р + dp равна весу газа, заключенного в объеме цилиндра с площадью основания, равной единице, и высотой dh (Рис. 2.1.11):
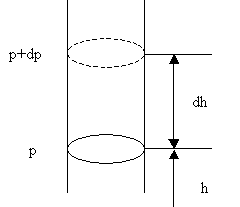
Рис. 2.1.11. К выводу барометрической формулы
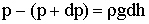 | (2.1.74) |
где ρ - плотность газа на высоте h.
Отсюда следует:
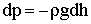 | (2.1.75) |
При условиях, близких к нормальным, газы, входящие в состав атмосферы, мало отличаются по своим свойствам от идеального газа. Поэтому, используя уравнение состояния идеального газа, для плотности газа можно записать:
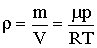 | (2.1.76) |
Подставляя (2.1.76) в (2.1.75), получим:
 | (2.1.77) |
откуда следует:
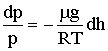 | (2.1.78) |
Для случая, когда температура постоянна, интегрируя (2.1.78), получим:
 | (2.1.79) |
где С - константа интегрирования.
Потенцируя (2.1.79) имеем соотношение:
 | (2.1.80) |
Пусть при h = 0 выполняется р = р0. Используя это условие, из (2.1.80) получим: р (h=0) = р0 = C. Окончательное выражение для зависимости атмосферного давления газа от высоты при данной температуре примет вид:
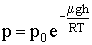 | (2.1.81) |
Эта формула называется барометрической. Из нее следует, что давление убывает с высотой тем быстрее, чем тяжелее газ (чем больше μ) и чем ниже температура (Рис. 2.1.12).

Рис. 2.1.12. Зависимость давления газа от высоты и температуры (μ1 < μ2, Т1 > Т2)
2.1.13. Распределение Больцмана
Заменив в (2.1.81) давление р = nkБТ, получим закон изменения концентрации газа в зависимости от высоты:
 | (2.1.82) |
Здесь n0 - число молекул в единице объема на высоте, равной нулю, n - их концентрация на высоте h. Преобразуем (2.1.82), используя связь 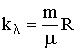 :
:
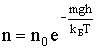 | (2.1.83) |
Из (2.1.83) следует, что с понижением температуры число частиц на высотах, отличных от нуля, убывает, обращаясь в нуль при T = 0 (Рис. 2.1.13).
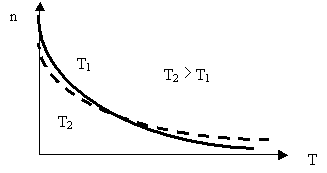
Рис. 2.1.13. Изменение концентрации частиц газа с высотой
При абсолютном нуле все молекулы расположились бы на поверхности земли. При высоких температурах, напротив, концентрация частиц слабо убывает с высотой, так что молекулы оказываются распределены по высоте почти равномерно.
Действительно, каждое конкретное распределение молекул по высоте устанавливается в результате совместного и конкурирующего действия двух факторов:
- притяжение молекул к Земле стремится расположить их на поверхности;
- тепловое движение препятствует этому и стремится распределить молекулы по высоте равномерно.
Чем больше масса и меньше температура, тем сильнее преобладает первый фактор, и молекулы окажутся сконцентрированы ближе к Земле. Например, молекулы тяжелого газа радона могут скапливаться в подвалах домов.
На разной высоте молекула с массой m обладает различным запасом потенциальной энергии:
 | (2.1.84) |
Поэтому формулу (2.1.83) можно представить так:
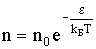 | (2.1.85) |
где n0 - концентрация молекул там, где потенциальная энергия молекулы равна нулю.
Л. Больцман доказал, что распределение (2.1.85) справедливо не только в случае поля силы тяжести, но и в любом потенциальном поле сил для совокупности любых одинаковых частиц, находящихся в состоянии хаотического теплового движения. Формулу (2.1.85) называют распределением Больцмана.
|
|

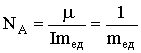
 Поэтому масса любого атома равна: 1,66·10-27А кг, масса любой молекулы равна: 1,66·10-27М кг.
Поэтому масса любого атома равна: 1,66·10-27А кг, масса любой молекулы равна: 1,66·10-27М кг.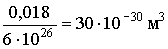 .
.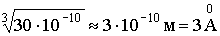 .
.