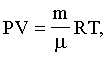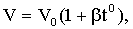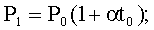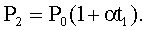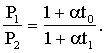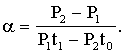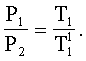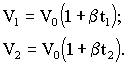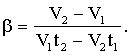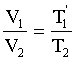где μ - молярная масса (для воздуха μ= 29·10-3кг/моль); R - газовая постоянная. Давление данной массы газа при изохорическом процессе изменяется линейно с температурой
где Р - давление газа при температуре t°C; P0 - давление газа при температуре 0°С, α- термический коэффициент давления газа. Объем данной массы газа при изобарическом процессе изменяется линейно с температурой
где V - объем газа при температуре t°C; V0- объем газа при температуре 0°С; β-коэффициент объемного расширения газа. Если газ точно подчиняется законом идеального газа, то 
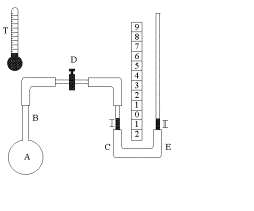
1)Для изучения законов идеального газа используется прибор, состоящий из колбы А с узкой стеклянной трубкой В, на конце которой имеется кран Д (рис.1). Кран Д при помощи резиновой трубки соединяется с водяным манометром С и служит для сообщения воздуха, находящегося в колбе А, с манометром. Манометр состоит из двух стеклянных трубок 1 и 2, соединенных между собой резиновой трубкой Е. Трубка 1 проградуирована в кубических сантиметрах (см³). Манометр закреплен на вертикальной подставке с миллиметровой шкалой, причем трубку 2 манометра можно перемещать вверх и вниз и закреплять на желаемой высоте. Для изменения состояния газа колба А помещается в сосуд с подогретой водой. 2) Прежде чем приступить к измерениям, подготовим установку к работе. Для этого опускаем трубку 2 вниз до отказа, вынимаем кран Д и устанавливаем уровень воды в трубках 1 и 2 манометра на нулевом делении шкалы (в случае необходимости - долить или отлить воды). Затем вставляем кран Д так, чтобы воздух колбы А сообщался с манометром. Отсчитываем начальные параметры воздуха: давление Р1 по барометру-анероиду (в мм. рт. ст.), температуру комнаты t°1 по прилагаемому к работе термометру, объем V исследуемой массы воздуха колбы известен. Итак, первое состояние воздуха колбы: P1, V1, T1, где T1 = t0° + 273°. 3)Переведем газ из первого состояния во второе изохорически. Для этого нагреваем воду в сосуде до температуры t1° ≈ 30° - 35°C и погружаем в него колбу так, чтобы она полностью находилась в воде, для чего колбу придерживаем. Воздух в колбе стремиться расшириться, но, ;поднимая трубку 2, поддерживаем объем воздуха постоянным, т.е. чтобы уровень воды в 1 трубке был на нулевом делении шкалы манометра. Закрепляем трубку 2 и отсчитываем по шкале манометра высоту столба воды h в миллиметрах (рис.2). Давление воздуха в колбе в этом случае будет Р2 = Р1 + h, где h - давление столба воды, выраженное в миллиметрах ртутного столба (мм.рт.ст.). Итак, второе состояние воздуха колбы: Р2, V1, T11, где T11= t1° + 273° P2 = P1 + h. Переведем газ из второго состояния в третье изобарически. Для этого нагреваем воду в сосуде до температуры t2° ≈ 40° - 45° и снова погружаем в него колбу. При этом газ будет изобарически расширяться. Отсчитываем по делениям, нанесенным на 1-ю трубку, изменение объема воздуха колбы ΔV в см3 (рис.3). Объем воздуха станет V2 = V1 + ΔV. Итак, третье состояние воздуха колбы: P2; V2; T2, где T2 = t2° + 273°, P2 = P1 + h. ПРИМЕЧАНИЕ: после отсчета ΔV следует перекрыть кран Д и опустить трубку 2 вниз до предела и снова установить кран Д так, чтобы воздух колбы А сообщался с манометром. 5)Опыт повторяем еще два раза так, как указано в пунктах 2, 3, 4. Воду каждый раз нагреваем до разных температур. Таблица 1
Упражнение №1 a)Пользуясь данными таблицы 1 для изохорического процесса, определить термический коэффициент давления воздуха α. Применяя для 1 и 2 состояний формулу (1.2), можно записать
Поделим эти уравнения друг на друга, получим
Откуда
Зная Р1; Р2; t0; t1, по формуле (1.5) вычисляем термический коэффициент давления газа для каждого из трех опытов. Оцениваем точность эксперимента путем подсчета средней квадратичной погрешности с надежностью α = 0,9. Результаты измерений заносим в таблицу. В отчете представить полный расчет величин. б) Зная значения параметров Р1; Т1; Р2; Т11 (из таблицы 1), проверить правильность закона Шарля:
Таблица 2
Объяснить причины приближенного выполнения этого равенства. Пользуясь равенством (1.4), получить формулу (1.6). Упражнение №2 Пользуясь данными таблицы 1 для изобарического процесса, определить коэффициент объемного расширения воздуха β. Применяя для 2 и 3 состояний формулу (1.3), можно записать
Откуда
Зная V1; V2; t1; t2, по формуле (1.8) вычисляем коэффициент объемного расширения воздуха для каждого из трех опытов. Таблица 3
б) Зная значения параметров V1; T11; V2; T2 (из таблицы 1), проверим правильность законов Гей-Люссака:
Объяснить причины приближенного выполнения этого закона в данной работе. Пользуясь равенством (1.7), получить формулу (1.9). Контрольные вопросы
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||